血液采集和样本注意事项
研究人员可以利用多种样本采集方法进行免疫组研究。本文件旨在定义、比较和对比我们目前内部使用的几种适用于全血的样本采集方法和下游存储选项。
本文件并非对所有可能的采集方法的全面回顾,但研究人员可以使用它来帮助确定最合适的采集策略,以实现预期结果。我们了解,样本与免疫组研究结合用于其他应用;因此,需要注意的是,样本可以以多种方式储存,具体取决于初始采集策略。如果计划进行其他类型的检测,则可能需要在采集时收集多种类型的血管。
无论研究人员采取何种方式,我们始终建议使用核酸稳定介质(如 Qiagen 的 RNAprotect 细胞试剂(货号 76526))来保存用于免疫组分析的细胞样本。对于组织,我们建议使用 RNAlater 稳定溶液(货号 76104)。这些试剂有助于确保提取过程后的高质量完整核酸。其他可接受的样本保存选项包括含有 RNA 稳定溶液的真空管(如 PaxGene 管)和冷冻保存细胞(只要遵循正确的冷冻和储存程序)。
有关非血液样本(分离细胞、组织、提取的核酸)的准备指导,请参阅我们的样本提交指南。
全血:“白膜”与 PBMC
研究人员通常收集全血作为免疫组分析的起始材料;然而,研究人员通常会关注特定的目标细胞亚群。在本节中,我们将简要回顾全血的组成,并比较“白膜层”和“PBMC”的定义。
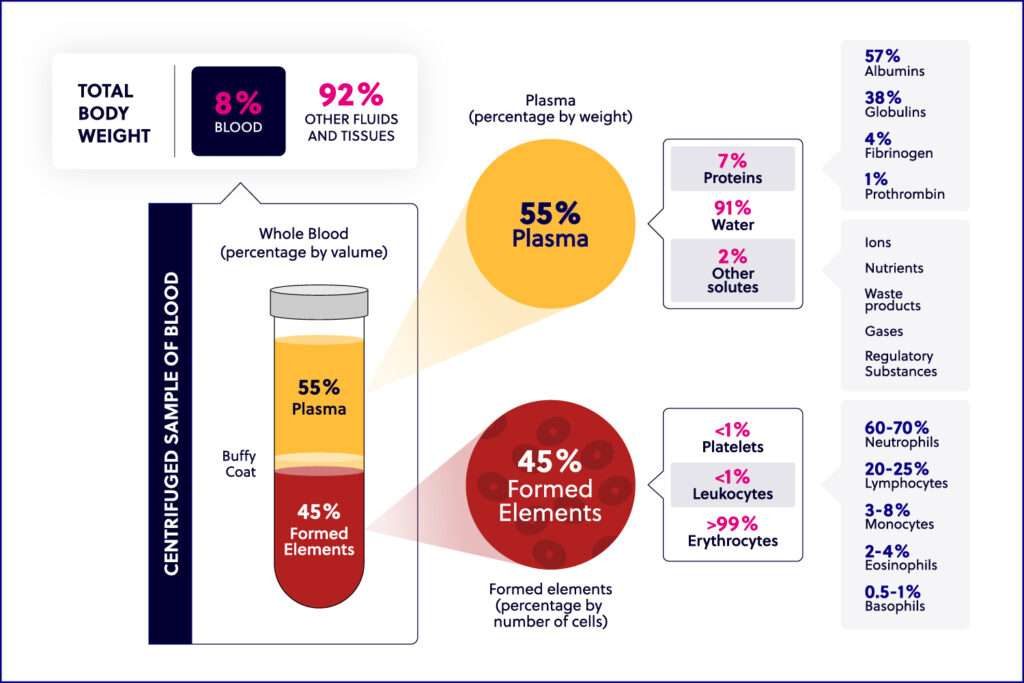
全血包含红细胞 (RBC)、白细胞 (WBC)、血小板和血浆。血浆含有蛋白质和其他营养物质。白细胞包括外周血单核细胞 (PBMC) 和多形核细胞 (PMNC)。淋巴细胞(T 细胞、B 细胞、NK 细胞)、单核细胞和巨噬细胞组成 PBMC,而中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞和肥大细胞组成 PMNC。
“白膜层”是抗凝血样中的一部分,在全血直接离心后,其中含有白细胞和血小板。“PBMC”通常通过使用 Ficoll 或类似试剂进行密度梯度离心获得,包括任何具有圆形细胞核的外周血细胞。虽然 PBMC 是白细胞的一种,但它们仅占所有白细胞的一小部分。我们使用一种内部方法从全血样本中分离白膜层,并使用另一种单独的方法分离 PBMC。需要注意的是,这里定义的两个术语不可互换。
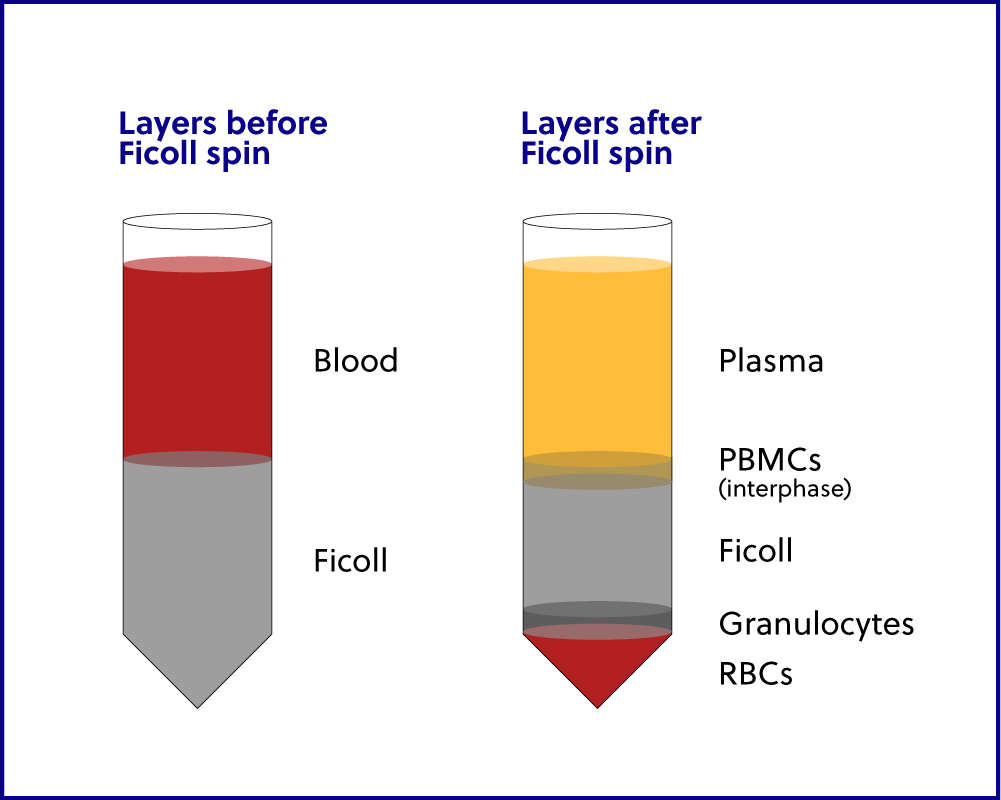
分离白膜和 PBMC 的收集方法
在本节中,我们将讨论研究人员为什么可能想要使用白膜或 PBMC,并介绍我们内部用来从全血中分离这两种样本的几种收集方法。
总白细胞
当特定研究的目标细胞包括来自 PBMCs 和 PMNCs 的细胞亚群时,应从全血中分离白膜层。这可以通过直接离心全血(有关白膜层分离的具体方法,请参阅在线资源)或通过红细胞裂解来实现。我们通常至少从 10 mL 全血中提取用于免疫组研究。分离白膜层后,可以对其进行处理以用于多种下游应用:核酸提取、冷冻保存、储存在 Qiagen 的 RNAprotect 细胞试剂(目录号 76526)中,或者根据可能的下游用途,结合使用这三种方法(如果需要)。
PBMC 分离
当目标细胞不包括来自 PBMCs
和 PMNCs 的细胞时,我们建议使用 Ficoll 梯度法将
WBC 分离成不同的层,如图 C 所示并如下所述。
对于任何类型的下游细胞分选,通常建议分离 PBMCs。Ficoll
分离可用于抽入
含有抗凝添加剂的真空管中的大多数全血样本。我们首选的真空管是
BD K2-EDTA 采血管。经过稀释、在 Ficoll 上分层
并离心后,PBMC 层很容易分离,并可进行
多种下游应用:核酸提取、冷冻保存、
细胞分选(台式或 FACS)、在 RNAprotect 细胞试剂上储存,或者
如果需要,可以结合使用这四种方法。
抽取的血液量取决于
下游过程。如果直接提取 RNA,建议
至少抽取 10 mL。对于细胞分选,下游细胞亚群的频率
会影响这一决定。在内部,对于某些研究,抽取的全血量可能在 20-40 mL 之间。有关 更多信息
,请参阅 iRepertoire 的分选和 RNA 提取指南。
Ficoll 梯度分离可用于分离
全血的不同层,通常是 PBMCs,并且可以使用两种不同
类型的真空管进行。
- 要进行手动 Ficoll 梯度分离,可以将全血
抽入含有抗凝剂添加剂的真空采血管中。同样,我们首选的
真空采血管是 BD K2-EDTA 采血管。用
特定缓冲液稀释后,将稀释的血液分层铺在市售的 Ficoll
梯度溶液上,然后按照 iRepertoire 的分类和 RNA 提取指南中的详细说明进行离心。注意:如果 使用某些核酸分离技术,
采血管中的肝素添加剂
可能会抑制下游逆转录和 PCR 。 - 要直接从全血中进行 Ficoll 梯度分离,可以将全血抽入含有 Ficoll 添加剂的真空管中。我们首选的真空管是含有柠檬酸钠的 BD Vacutainer CPT 细胞制备管。抽血后,可以对管进行离心,并从管中倒出 PBMC。
不同采集管的比较
在本节中,我们将列出将血液抽入 BD K2-EDTA 血管或含有柠檬酸钠的 BD Vacutainer CPT 细胞制备管的优点。
BD K2-EDTA 采血管
优点:
- 在室温下储存直至加工
- 根据血液的处理方式,可以分离白膜或 PBMC
- 直接从血管中提取白细胞总数
- 具有抗凝血作用
- EDTA 与下游 RT-PCR 应用兼容(与可抑制 RT 酶的肝素钠不同)
- 根据所需血液量提供多种尺寸(2、3、4、6 和 10 毫升选项)
- 提供最多的处理选项:红细胞裂解、白细胞分离和 Ficoll 梯度分离
限制:
- 必须在收货后 24-48 小时内处理
- 需要在旋转器上室温储存以防止细胞死亡和部分凝固
- 不含任何核酸稳定添加剂
- 需要手动处理,这可能很耗时
BD Vacutainer CPT 细胞制备管(含柠檬酸钠)
优点:
- 在室温下储存直至加工
- 分离 PBMC 的时间高效方法(无需手动添加 Ficoll 梯度溶液;离心过程中可使用制动,从而大大缩短处理时间)
- 减少实验室耗材浪费
- 可与其他采血管一起抽取
限制:
- 必须在收货后 2 小时内处理
- 一旦将血液抽入试管,PMNC 就无法轻易分离(制造商提供了协议,但该层不易接近)
- 初始成本比 BD K2-EDTA 采血管更高
- 不含任何核酸稳定添加剂
- 每管限量 4 或 8 mL
PAXgene 血液 RNA 管
在本节中,我们将讨论研究人员为何可能要
考虑第三种类型的采血管,即 PreAnalytiX PAXgene 血液
RNA 管。我们还将列出其优点和局限性。
当特定研究的目标细胞包括
来自 PBMCs 和 PMNCs 的所有细胞亚群,并且 WBCs 的总 RNA 是
下游应用的预期核酸时,可以将全血
直接抽入真空管中,该真空管旨在立即稳定 RNA。我们
首选的真空管是 PreAnalytiX PAXgene 血液 RNA 管。抽血后
,可以使用 PAXgene 血液 RNA 试剂盒对管进行离心和处理,
以提取高质量、完整的 RNA。
优点:
- 可在室温下保存长达 3 天
- 可在 2-8°C 下保存长达 5 天
- 可在 -20°C 或 -70°C 下保存长达 11 年
- 含有 RNA 稳定添加剂
- 从全血中分离总 RNA 的时间高效方法(无需红细胞裂解处理)
- 可与其他采血管一起抽取
- 可在室温下解冻
- 使用相应的 PAXgene Blood RNA Kit 进行处理
- 在需要 RNA 之前无需处理试管
- 经常用于临床研究
限制:
- 加工前需要 2 小时的孵化期
- 一旦血液被抽入试管,细胞亚群(PBMCs 和 PMNCs)就无法单独分离
- 使用采血管和相应的提取套件时初始成本较高
- 与冷冻保存、细胞分选(台式或 FACS)或 RNAprotect 细胞试剂上特定细胞亚群的储存不兼容
- 每个采集管限量 2.5 mL 全血
- 制造商提供的抽血特殊说明(采血员在开始之前需要熟悉该过程)
从血液中提取的 RNA
对于服务样品,我们要求的量比单次反应所需的量要多,以便 在必要时
有足够的量进行重复扩增。RNA 输入量 取决于起始样品类型。如果您使用的是全血(无分 选细胞)的总 RNA,我们建议使用 1,000 ng RNA 输入。 对于肿瘤或各种组织类型,建议量相同。虽然这个输入量可能看起来 很高,但请记住,样品中也含有非免疫特异性 RNA。这种 RNA 将充当背景噪音,因此我们希望确保有足够的免疫特异性 RNA 进入反应。
随着样本的免疫特异性增强(例如,从全血中纯化 PBMC 可丰富当前的适应性免疫系统),建议的 RNA 输入量会下降。根据样本可用性,使用 PBMC 特异性 RNA 的服务项目平均输入量为 300-500 ng。当样本包含分选细胞时,建议的输入量会进一步下降。这是因为免疫特异性 RNA 的浓度更高。当处理分选细胞时,我们使用的 RNA 量仅为 20 pg(优质、完整)。在考虑输入多少 RNA 时,始终要考虑 RNA 的来源和 RNA 质量。RNA 质量通常比数量更重要。
有关所有其他类型样本的收集/处理/提交的指导以及处理 RNA 的一般技巧,请参阅我们的样本提交指南